Por Camila Redel y Bárbara Vallejos.
Antes de comenzar a estudiar acerca de la química orgánica, es importante tener conocimientos previos, donde la química funcional aporta gran parte de los contenidos base, dentro de los cuales se encuentra las interacciones de átomos intramoleculares e intermoleculares. Además, los enlaces (interacciones intramoleculares) son cruciales para entender el comportamiento de las moléculas y su distribución en el espacio.
Antes de comenzar a estudiar acerca de la química orgánica, es importante tener conocimientos previos, donde la química funcional aporta gran parte de los contenidos base, dentro de los cuales se encuentra las interacciones de átomos intramoleculares e intermoleculares. Además, los enlaces (interacciones intramoleculares) son cruciales para entender el comportamiento de las moléculas y su distribución en el espacio.
En este documento se encuentra la descripción de algunas de las interacciones intermoleculares más comunes, la ión-ión, ión-dipolo, dipolo-dipolo (dentro de las cuales se encuentra el puente de hidrógeno), y las fuerzas de London (ión- dipolo inducido, dipolo- dipolo inducido). Por otra parte, se desarrollarán las diferencias entre los compuestos covalentes e iónicos, además de mencionar el enlace covalente dativo y su estructura, con el fin de tener una guía respecto a los comportamientos y características de cada uno de éstos, lo que será útil para reconocer tipos de compuestos.
ATRACCIONES INTRAMOLECULARES
ENLACE COVALENTE
La atracción mutua de los núcleos y el par de electrones constituye el enlace covalente, que mantiene juntos a los átomos.
Cada átomo en un enlace covalente “cuenta” a los electrones compartidos como si fueran completamente propios. En consecuencia, un par de electrones compartidos llena simultáneamente el nivel externo de ambos átomos.
El par compartido o par enlazante se representa ya sea por un par de puntos o una línea. Ej.: H:H o H-H.
Tipos de enlace:
Enlaces sencillos: consisten únicamente de un par de electrones enlazantes.
Enlaces múltiples: se dividen en
enlaces dobles: que constan de dos pares de enlazantes y cuatro electrones compartidos entre dos átomos. Ej.: Etileno.
enlaces triples: consiste en tres pares enlazantes, con lo que dos átomos comparten seis electrones. Ej.: N2
ENLACE COVALENTE COORDINADO
El enlace covalente dativo o coordinado es un tipo de enlace covalente que tiene la peculiaridad de que es uno de los dos átomos el que aporta los 2 electrones, dejando la misión de dejar un orbital libre al otro átomo.
Para que se presente este tipo de enlace, se requiere que el átomo donador tenga un par de electrones libres en un orbital exterior y el átomo aceptor tenga capacidad para recibir ese par de electrones en su última capa de valencia.
Este enlace es común en los óxidos no metálicos y en los iones complejos de los metales ligeros. Este enlace es responsable del ión amonio NH4+, donde el nitrógeno cede los dos electrones para que el cuarto oxígeno se una a él, de tal manera que los cuatro hidrógenos son iguales.
ENLACE IÓNICO
Es la transferencia de electrones, de un metal a un no metal para formar iones que se unen en un compuesto iónico sólido, lográndose una configuración en donde hay un nivel externo lleno de electrones (ya sea dos u ocho), estableciéndose la regla del octeto.
ENLACE METÁLICO
En este enlace, muchos átomos metálicos agrupados comparten sus electrones de valencia, para formar un mar de electrones deslocalizado, que atrae entre sí a los centros de los iones metálicos
PROPIEDADES DE LAS SUSTANCIAS IÓNICAS Y COVALENTES
SUSTANCIAS COVALENTES | SUSTANCIAS IÓNICAS |
- Están formadas por moléculas, salvo excepciones. - Tienen puntos de fusión y ebullición relativamente bajos. A temperatura ambiente pueden ser gaseosas, líquidas o sólidas, dependiendo de la intensidad de sus fuerzas intermoleculares. - Serán solubles en solventes polares si son polares, y en solventes no polares si son no polares. - No conducen la corriente eléctrica, ya que no existen cargas eléctricas que puedan moverse. | - No están formadas por moléculas, sino por redes cristalinas donde se alternan cationes y aniones. - Tienen puntos de fusión y ebullición muy altos. A temperatura ambiente son sólidos cristalinos. - Son solubles en solventes en solventes muy polares, principalmente en agua. - No conducen la corriente eléctrica en estado sólido, pero sí lo hacen en estado líquido o en solución. |
ATRACCIONES INTERMOLECULARES
Las atracciones intermoleculares, se refieren a fuerzas que mantienen “juntas” a moléculas diferentes, es decir, permanecen como un conjunto de moléculas y no cada una separada de otra. Este fenómeno ocurre gracias a cargas de alguna zona de la molécula, permitiendo que otra, con una carga contraria, se mantenga a poca distancia, permitiendo la formación de sustancias en diferentes estados de la materia.
Estas fuerzas se pueden dar más o menos fuertes, dependiendo del tipo de molécula involucrada; en el caso de las que presentan enlaces iónicos, como el ión- ión, ión-dipolo e ión-dipolo inducido, suelen ser atracciones más fuertes que las que tienen de tipo covalente, presentándose estas últimas en los gases y son clasificadas como “fuerzas de Van der Waals”, donde se encuentran las fuerzas de dispersión (o London), dipolo-dipolo, dipolo-dipolo inducido.
- IÓN – IÓN
Los iones, son moléculas que tienen enlaces iónicos, tomando cada átomo una carga formal ya sea positiva o negativa. Es por esto, que las cargas opuestas se atraen, con estas interacciones fuertes y formando redes cristalinas sólidas.
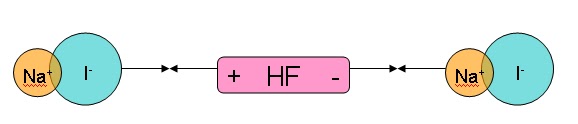
- IÓN – DIPOLO
Un dipolo es una molécula que está unida por enlaces covalentes, que se dan por la diferencia de electronegatividad, pero como no son suficientes para separar totalmente las cargas, son relativas dentro de ella, permitiendo un efecto similar al de la interacción dipolo-dipolo; no obstante, no tiene la misma fuerza y estabilidad de la anterior.
Gracias a este efecto, es cómo las sales pueden disolverse en sustancias líquidas covalentes dipolares
- DIPOLO – DIPOLO
Estas atracciones son parte de las fuerzas de Van der Waals, en las cuales participan moléculas covalente polares y sus cargas relativas permiten esta cercanía.
· PUENTES DE HIDRÓGENO
Ocurre un fenómeno especial cuando el hidrógeno está unido a átomos de Oxígeno, Nitrógeno o Fluor, que son pequeños pero con alta electronegatividad, produciendo un enlace covalente muy polar, y esto provoca que el hidrógeno forme “puentes” un poco más resistentes que las otras interacciones dipolo- dipolo, donde el hidrógeno está parcialmente positivo y es atraído por un par de electrones libres sobre otro átomo.
- FUERZAS DE LONDON
Cuando una molécula que tiene polaridad, se acerca a otra apolar, también ocurre una cierta atracción, muy leve, pero que de todas formas mantiene a cierta cercanía a las moléculas, éstas son las llamadas fuerzas de London. Este suceso ocurre al inducir a la polarización a una molécula apolar, la que toma una carga parcial gracias a que las nubes electrónicas se desplazan formando una carga negativa en donde se encuentren y una positiva en su origen, produciendo un momento bipolar inducido. Dentro de estas se encuentran en orden descendente de atracción, la ión-dipolo inducido, dipolo-dipolo inducido, y una atracción que ocurre cuando dos sustancias son apolares que tiene el mismo efecto pero mucho menos fuerte.
· IÓN - DIPOLO INDUCIDO
Las nubes electrónicas se distorsionan para tomar un carga parcial en un sector de la molécula.
· DIPOLO - DIPOLO INDUCIDO
Ocurre al igual que con el ión pero la atracción de las nubes es menor.
REFERENCIAS
·De la Fuente , M, (2007), Clases de interacciones intermoleculares, [recurso pdf: quim-_ClaseInteracciones2007Anotada.pdf ]
·Mejías, P. (2011), Material de apoyo, clases de cátedra, Química funcional, Temuco: Universidad Católica de Temuco.
·Silberberg, M. (2002), Química General, la naturaleza molecular del cambio y la materia, México: McGraw- Hill.
·Wade, L. (2004), Química Orgánica, Madrid: Peardon, Prentice Hall.
ANEXOS
Presentación power point Enlaces Moleculares por Carla Valenzuela y Génesis García
ANEXOS
Presentación power point Enlaces Moleculares por Carla Valenzuela y Génesis García







No hay comentarios:
Publicar un comentario